O Princípio da Exclusão de Pauli, diz que acima de 2 elétrons não podem ficar em um orbital, se eles estiverem em spins contrários.
Logo o Princípio de Pauli explica:
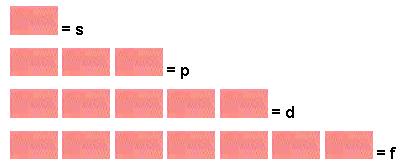
Subnível s é considerado a região que “abriga” 2 elétrons, ou seja, cada subnível s é considerado um orbital s. Portanto a camada K é um orbital.
Subnível p é considerado a região que “abriga” no máximo 6 elétrons, logo o subnível p é composto por 3 orbitais, que são representados por px, py e pz.
Subnível d é composto por 5 orbitais, logo comporta até 10 elétrons.
Subnível f é composto por 7 orbitais, logo comporta até 14 elétrons.
Subnível p é considerado a região que “abriga” no máximo 6 elétrons, logo o subnível p é composto por 3 orbitais, que são representados por px, py e pz.
Subnível d é composto por 5 orbitais, logo comporta até 10 elétrons.
Subnível f é composto por 7 orbitais, logo comporta até 14 elétrons.
Para exemplificar, vamos simbolizar o orbital da seguinte forma, Vejamos:
- Orbital possuindo apenas um elétron incompleto
- Orbital possuindo apenas um elétron contrário ao anterior.
- Orbital possuindo 2 elétron, cheios e completos, de spin contrários.
- Simbologia dos subníveis e orbital.

 18/06/2012
18/06/2012


The 7 Best Casinos in Chicago - Mapyro
ResponderExcluirThe 7 Best Casinos in 청주 출장안마 Chicago · Grand Falls Hotel & Casino · Grand 평택 출장샵 Falls 진주 출장안마 Resort & Casino · Grand Victoria Hotel & 광주 출장안마 Casino · 태백 출장안마 Grand Villee Casino Resort